¡Buenos días! Hoy os voy a hablar de un tema que debería haber estado en el blog mucho tiempo antes (gracias Jorge por darme la idea). ¿Os suena la CRISPR? Es probable que sí aunque no seáis científicos, porque es un tema al que desde hace años se le ha dado mucho bombo. Especialmente porque ha revolucionado la forma de entender la edición génica y porque uno de los principales implicados es español. Hoy os quiero explicar qué es la CRISPR, cómo funciona y por qué ha revolucionado la ciencia. ¡Vamos allá!
Las bacterias también se defienden
"Hala, Raquel, pero qué estás contando, si has dicho que nos ibas a hablar de edición génica." Sí, sí, pero es que aquí empieza todo. Y empieza con Francis Mójica, un microbiólogo que estudiaba las bacterias en las salinas de Santa Pola. Un día, analizando unas secuencias del genoma de esas bacterias (de su DNA, vaya) se dieron cuenta de que había unos trozos que se repetían cada poco, y eso les sonó muy raro. Descartado que pudiera tratarse de un error, se pusieron a estudiar qué estaba pasando y no creerás lo que ocurrió después.
Se dieron cuenta de que estas secuencias que se repetían cada poco formaban parte de una especie de sistema de defensa de las bacterias, que se ha comparado a nuestro sistema inmune. Resulta que las bacterias, igual que nosotros, pueden sufrir infecciones por virus. Vale, no pueden pillar la gripe, pero hay un tipo de virus específicos, los bacteriófagos, capaces de infectarlas y llegar a matarlas. Para defenderse de ellos vieron que las bacterias tenían estos trozos de DNA repetidos y que funcionaban de forma bastante compleja, y muy bien para cumplir con su función.
No voy a entrar ahora en las clases de Biología Molecular que me dieron en tercero pero os prometo que lo vais a entender. En el DNA de las bacterias hay secuencias repetidas y palindrómicas, es decir, que se leen igual en un sentido que en otro. Cuando un virus infecta a la bacteria, unas proteínas específicas se ponen en marcha y escanean su DNA. Si es desconocido, es decir, que está infectando a la bacteria por primera vez, las proteínas son capaces de cortar algún cacho de su DNA y meterlo entre esas secuencias repetidas del DNA de la bacteria.
Esto lo hacen para cada virus nuevo que entran y todas se van acumulando. Es decir, en el DNA de la bacteria se va creando un archivo que recuerda todos los virus que le han infectado, como si fuera un archivo de malhechores. Entonces, cuando entra un virus ya conocido, hay otras proteínas que se ponen en marcha (entre ellas las proteínas Cas, que quizás os suenen por CRISPR/Cas9). La parte del DNA que contiene los trozos repetidos se transcribe, es decir, se pasa a RNA, una sola cadena. Los trozos, al ser palindrómicos y repetidos, se pueden unir entre ellos (acordaos de que en el RNA, A se une con U y C con G). La forma tan rara que tenía, con palíndromos y repeticiones hace que tenga una forma concreta para realizar su función.
Hay diferentes formas de atacar a los virus y no voy a entrar en ello, pero en todas lo que ocurre es que estos trozos de RNA que se acaban de transcribir se juntan con unas proteínas, como las Cas, que escanean el genoma del virus. Cuando llegan a una zona del genoma del virus que coincide con la que se había guardado en el DNA, las proteínas pueden cortar por ahí. Así, si destruyen el genoma del virus ya no puede causar daño.
Hay diferentes formas de atacar a los virus y no voy a entrar en ello, pero en todas lo que ocurre es que estos trozos de RNA que se acaban de transcribir se juntan con unas proteínas, como las Cas, que escanean el genoma del virus. Cuando llegan a una zona del genoma del virus que coincide con la que se había guardado en el DNA, las proteínas pueden cortar por ahí. Así, si destruyen el genoma del virus ya no puede causar daño.
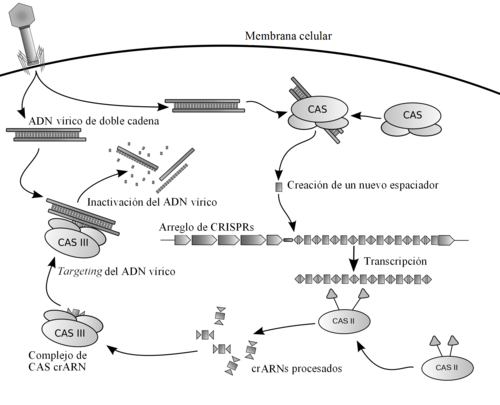 |
| Esquema de cómo funciona esto. ¿Dudas? A los comentarios. |
Como habéis visto, este sistema se basa en reconocer lo que ya ha atacado antes, para después poderlo atacar. Pero ¿esto qué tiene que ver con la edición génica?
Antes de seguir, por favor, quiero aclarar que CRISPR viene de Clustered Regularly Interspaced Short Palindromic Repeats, es decir, repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas. Y se pronuncia crísper. Sí, como lo de las neveras.

CRISPR/Cas9 y la edición génica
De primeras, podía parecer que esto no tiene mucha utilidad, más que una curiosidad interesante. Sin embargo, más estudio reveló que podía tener unas funciones muy interesantes. Fijaos en lo que os he explicado antes: usamos una plantilla de RNA con una forma específica (es decir, lo que se había guardado antes del virus) para reconocer un trozo de DNA igual y hacerle un corte. Eso no parece específico de bacterias y virus; todos tenemos DNA.
Básicamente, los elementos que intervienen aquí se pueden utilizar en otras especies, conservando las proteínas que cortan y los mecanismos. Aquí tuvieron un papel muy destacado dos científicas de diferentes grupos, Jennifer Doudna y Emmanuelle Charpentier, que fueron las que estudiaron las proteínas del corte y que, junto a Mójica, están en las quinielas de Nobel (sí, dos señoras y un español, podría ser bonito).
La forma de modificar el genoma con este sistema entonces, es meter una secuencia de DNA que se ha diseñado específicamente para que se parezca a las que hay en las bacterias, con un trozo que coincida con el gen diana. Además, se integran también las proteínas de bacterias, como Cas9. Lo que ocurre dentro de las células es que se transcribe el DNA que hemos metido, las proteínas de bacteria lo cogen y juntas hacen lo mismo que harían dentro de la bacteria: buscan una zona del DNA que reconocer y la cortan. Básicamente, nosotros metemos proteínas de corte y algo que les indica dónde deben cortar.
Vale, dentro de la bacteria cortan el DNA del virus, pero aquí lo que hacen es cortar el genoma de la célula. Normalmente, cuando se corta un trozo de DNA, los sistemas de la célula son capaces de repararlo por sí solos, pero nunca lo hacen perfecto, sino que cometen errores. Entonces, el gen que ha sido cortado se inactiva.
Otra opción es introducir una plantilla de reparación, es decir, un fragmento extra de DNA con lo que queremos cambiar. Cuando los sistemas de reparación de la célula intentan arreglar el corte, usan esta plantilla para corregir según lo que les hemos indicado, así es mucho más preciso.
Este sistema es muy sencillo porque solo se basa en meter un poco de DNA en la célula, algo que sabemos hacer desde hace tiempo. Esta sencillez, así como la limpieza, lo ha convertido en un éxito, ya que los sistemas que se utilizaban antes funcionaban peor y eran más farragosos.
Si te has quedado decepcionado con esto, siento decirte que no llegas a comprender la importancia de todo esto. No solo de hacer terapia génica vive el hombre, hay muchas más cosas con importancia. Y ser capaces de producir mejores plantas o de estudiar las enfermedades en animales son algunas de ellas.
Además, esto está todavía en ensayos clínicos de humanos, porque es una herramienta que conocemos hace poco. Sí, permite editar el genoma de cualquier célula, pero hay muchas cosas todavía que tenemos que conocer. Sin ir más lejos, hace poco, la revista Nature publicó una noticia pidiendo precaución en este aspecto y diciendo que hace falta recopilar muchos más datos antes de empezar a usarlo.
En el futuro, cuando se completen estos ensayos (hay que decir que en China hacen las cosas más a lo loco y son más permisivos en este tema), CRISPR podría ser una buena alternativa para tratar enfermedades genéticas en humanos. Permitiría que los genes se introdujeran en la zona concreta, por ejemplo, para tratar una atrofia espinal. Otra opción sería modificar los cigotos, es decir, la unión entre óvulo y espermatozoide, mucho antes de que el embrión comenzara a desarrollarse.
Es probable que en el futuro haya bastantes más aplicaciones de esta técnica, más que nada porque se puede emplear de diversas maneras. Hay diferentes proteínas de corte que no son Cas9 y también variantes en diferentes organismos. En este artículo podéis leer algunas aplicaciones sorprendentes más, por ejemplo, cómo puede aplicarse al diagnóstico de enfermedades.
También existen problemas de su uso que no se han solucionado todavía. La buena noticia es que esto supuso una revolución tan grande que ahora hay muchísimos grupos (y muy buenos) investigando en ello.
En el futuro, confío en que la edición genética sea algo mucho más cotidiano de lo que es ahora, que solo se utiliza generalmente en casos extremos. Sin embargo, esto tiene un aspecto más: no sólo hay que saber modificar sino saber cuándo y qué cambiar. Para poder usar la edición genética tenemos que saber bien qué enfermedades están causadas por mutaciones, qué mutaciones son esas y qué hay que tocar para solucionarlos. Esto puede parecer una chorrada, pero hay enfermedades muy graves y bastante conocidas, como la ELA o en Alzheimer, de las que no se conoce la causa.
Por otro lado, seguro que en poco tiempo se avanza un montón, igual que ha pasado con otras cosas. En cuanto se demuestre su seguridad se empezará a usar en personas para las que sea su última esperanza (como en enfermos terminales), ya que en ellos cualquier mejora es una enorme victoria. Si aquí funcionan bien, creo que es cuestión de tiempo que empiecen a usarse de manera más amplia.
En general, yo creo que la terapia génica es una gran solución, porque va a atajar la raíz del problema, no los síntomas. Además, puede aplicarse de formas que otras terapias no pueden y ha demostrado ser muy eficaz. No solo eso, sino que ya os he explicado que CRISPR puede usarse también en muchas más cosas además de enfermedades, como animales y plantas trasgénicos.
Pero además de todo esto, presenta una serie de problemas éticos, mayormente por lo que supone ser capaces de editar genomas así. ¿Hasta dónde podemos llegar?¿Puedo modificar el genoma de mis hijos?¿Debería decírselo? También hay problemas con las patentes, ya que han colaborado muchos grupos distintos. En su día se pidió ir con la calma (podéis ver la charla TED de Jennifer Doudna aquí), pero le han hecho 0 caso, la verdad, y todo el mundo se ha abalanzado como loco sobre estas nuevas herramientas.
Pero qué queréis que os diga, quizás esta técnica nos abra la puerta a un futuro de humanos, animales en general y plantas modificados para un futuro megatecnológico donde la naturaleza esté a nuestro servicio. Pero esa especulación os la dejo a vosotros.
Y hasta aquí llega todo lo que os quería contar. Por lo visto estoy cumpliendo muy bien con lo de hacer entradas más cortas, veremos cuánto me dura. Espero que esta entrada os haya resultado muy útil y os haya permitido acercaros al tema de moda del momento. Si os ha gustado no olvidéis dejarme un comentario, compartir por las redes y, por qué no, invitarme a un café. ¡Hasta la próxima entrada!
 |
| Charpentier, Doudna y Mójica, los principales implicados aquí. |
La forma de modificar el genoma con este sistema entonces, es meter una secuencia de DNA que se ha diseñado específicamente para que se parezca a las que hay en las bacterias, con un trozo que coincida con el gen diana. Además, se integran también las proteínas de bacterias, como Cas9. Lo que ocurre dentro de las células es que se transcribe el DNA que hemos metido, las proteínas de bacteria lo cogen y juntas hacen lo mismo que harían dentro de la bacteria: buscan una zona del DNA que reconocer y la cortan. Básicamente, nosotros metemos proteínas de corte y algo que les indica dónde deben cortar.
Vale, dentro de la bacteria cortan el DNA del virus, pero aquí lo que hacen es cortar el genoma de la célula. Normalmente, cuando se corta un trozo de DNA, los sistemas de la célula son capaces de repararlo por sí solos, pero nunca lo hacen perfecto, sino que cometen errores. Entonces, el gen que ha sido cortado se inactiva.
Otra opción es introducir una plantilla de reparación, es decir, un fragmento extra de DNA con lo que queremos cambiar. Cuando los sistemas de reparación de la célula intentan arreglar el corte, usan esta plantilla para corregir según lo que les hemos indicado, así es mucho más preciso.
 |
| Esquemas de cómo puede usarse CRISPR/Cas9 para modificar diferentes cosas. Quizás os parezca avanzado, pero no os deis demasiado mal. Si tenéis dudas, ya sabéis. |
Aplicaciones de CRISPR y su futuro
CRISPR sirve para un montón de cosas. Supongo que muchos de vosotros estabais pensando en terapia génica, en curar enfermedades de personas, pero eso no es lo mayoritario. No, ahora se usa mucho para generar animales modelo (es decir, un animal que tenga la misma enfermedad genética que una persona, así se puede estudiar mejor) y para hacer modificación genética en plantas, vamos, transgénicos con mayor productividad, que aguanten más, más nutritivos...etc.Si te has quedado decepcionado con esto, siento decirte que no llegas a comprender la importancia de todo esto. No solo de hacer terapia génica vive el hombre, hay muchas más cosas con importancia. Y ser capaces de producir mejores plantas o de estudiar las enfermedades en animales son algunas de ellas.
Además, esto está todavía en ensayos clínicos de humanos, porque es una herramienta que conocemos hace poco. Sí, permite editar el genoma de cualquier célula, pero hay muchas cosas todavía que tenemos que conocer. Sin ir más lejos, hace poco, la revista Nature publicó una noticia pidiendo precaución en este aspecto y diciendo que hace falta recopilar muchos más datos antes de empezar a usarlo.
En el futuro, cuando se completen estos ensayos (hay que decir que en China hacen las cosas más a lo loco y son más permisivos en este tema), CRISPR podría ser una buena alternativa para tratar enfermedades genéticas en humanos. Permitiría que los genes se introdujeran en la zona concreta, por ejemplo, para tratar una atrofia espinal. Otra opción sería modificar los cigotos, es decir, la unión entre óvulo y espermatozoide, mucho antes de que el embrión comenzara a desarrollarse.
Es probable que en el futuro haya bastantes más aplicaciones de esta técnica, más que nada porque se puede emplear de diversas maneras. Hay diferentes proteínas de corte que no son Cas9 y también variantes en diferentes organismos. En este artículo podéis leer algunas aplicaciones sorprendentes más, por ejemplo, cómo puede aplicarse al diagnóstico de enfermedades.
También existen problemas de su uso que no se han solucionado todavía. La buena noticia es que esto supuso una revolución tan grande que ahora hay muchísimos grupos (y muy buenos) investigando en ello.
 |
| Feng Zhang, uno de los que más está investigando en aplicaciones nuevas |
En el futuro, confío en que la edición genética sea algo mucho más cotidiano de lo que es ahora, que solo se utiliza generalmente en casos extremos. Sin embargo, esto tiene un aspecto más: no sólo hay que saber modificar sino saber cuándo y qué cambiar. Para poder usar la edición genética tenemos que saber bien qué enfermedades están causadas por mutaciones, qué mutaciones son esas y qué hay que tocar para solucionarlos. Esto puede parecer una chorrada, pero hay enfermedades muy graves y bastante conocidas, como la ELA o en Alzheimer, de las que no se conoce la causa.
Por otro lado, seguro que en poco tiempo se avanza un montón, igual que ha pasado con otras cosas. En cuanto se demuestre su seguridad se empezará a usar en personas para las que sea su última esperanza (como en enfermos terminales), ya que en ellos cualquier mejora es una enorme victoria. Si aquí funcionan bien, creo que es cuestión de tiempo que empiecen a usarse de manera más amplia.
En general, yo creo que la terapia génica es una gran solución, porque va a atajar la raíz del problema, no los síntomas. Además, puede aplicarse de formas que otras terapias no pueden y ha demostrado ser muy eficaz. No solo eso, sino que ya os he explicado que CRISPR puede usarse también en muchas más cosas además de enfermedades, como animales y plantas trasgénicos.
Pero además de todo esto, presenta una serie de problemas éticos, mayormente por lo que supone ser capaces de editar genomas así. ¿Hasta dónde podemos llegar?¿Puedo modificar el genoma de mis hijos?¿Debería decírselo? También hay problemas con las patentes, ya que han colaborado muchos grupos distintos. En su día se pidió ir con la calma (podéis ver la charla TED de Jennifer Doudna aquí), pero le han hecho 0 caso, la verdad, y todo el mundo se ha abalanzado como loco sobre estas nuevas herramientas.
Pero qué queréis que os diga, quizás esta técnica nos abra la puerta a un futuro de humanos, animales en general y plantas modificados para un futuro megatecnológico donde la naturaleza esté a nuestro servicio. Pero esa especulación os la dejo a vosotros.
Y hasta aquí llega todo lo que os quería contar. Por lo visto estoy cumpliendo muy bien con lo de hacer entradas más cortas, veremos cuánto me dura. Espero que esta entrada os haya resultado muy útil y os haya permitido acercaros al tema de moda del momento. Si os ha gustado no olvidéis dejarme un comentario, compartir por las redes y, por qué no, invitarme a un café. ¡Hasta la próxima entrada!


No hay comentarios:
Publicar un comentario